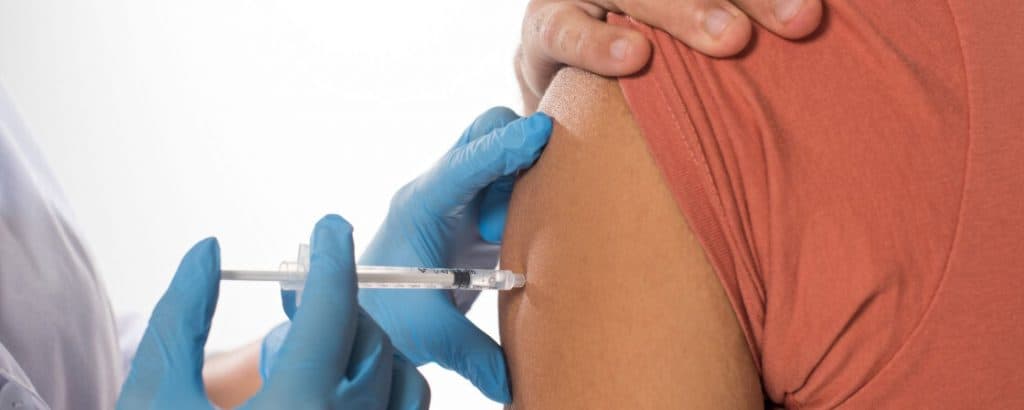
Ruszyły szczepienia przeciwko COVID-19. Ministerstwo Zdrowia na swoich stronach umieściło materiały informacyjne na temat procesu szczepień oraz badań jakim zostały poddane szczepionki na COVID-19. Ta akcja edukacyjno-informacyjna ma na celu zmniejszenie obaw oraz zachęcenie do poddawania się szczepieniom na COVID-19.
Materiały informacyjne dla szpitali i pacjentów dotyczące szczepień przeciwko COVID-19
Ministerstwo Zdrowia opublikowało na swoich stronach materiały informacyjne dotyczące szczepień po to, by cały proces był dobrze znany zarówno lekarzom, jak i pacjentom. W jednym miejscu zostały udostępnione wszystkie niezbędne informacje – ulotka szczepionki przeciw COVID-19 Comirnaty, kwestionariusz pacjenta potrzebny do szczepienia, a także wytyczne dla szpitali i podmiotów odpowiedzialnych za dystrybucję i przechowywanie szczepionek. Przygotowano także materiały do druku dla punktów szczepień m.in. – tablice informujące o godzinach pracy placówki czy strzałki pozwalający pacjentom dojść do punktu szczepień.
Poniżej podajemy link, pod którym można znaleźć ww. materiały:
https://www.gov.pl/web/szczepimysie/materialy-informacyjne-dla-szpitali-i-pacjentow-dotyczace-szczepien-przeciw-covid-19
Szczepionki przeciwko COVID-19 – dlaczego są bezpieczne?
Dodatkowo Ministerstwo Zdrowia przygotowało także informacje o badaniach jakie były prowadzone nad szczepionką COVID-19 oraz o procedurach jej dopuszczenia do stosowania.
Poniżej przytaczamy te informacje w formie, w jakiej zostały opublikowane na stronach Ministerstwa Zdrowia:
Prace nad szczepionkami COVID-19 przeprowadzano według najwyższych standardów bezpieczeństwa.
Wieloetapowe badania
- Po wyprodukowaniu szczepionki w laboratorium badawczym prowadzi się badania in vitro oraz w modelach zwierzęcych, które mają wykazać, czy szczepionka ma działanie ochronne przed wywoływaną przez niego chorobą zakaźną. Bada się również właściwości toksykologiczne i farmakologiczne.
- Po udowodnieniu bezpieczeństwa oraz analizie potencjalnej skuteczności przechodzi się do kluczowego etapu prac – badań klinicznych z udziałem ochotników. Badania kliniczne I fazy prowadzone są z udziałem zdrowych ochotników, a ich celem jest ustalenie czy szczepionka jest bezpieczna i czy wywołuje oczekiwany efekt. W tej fazie ustala się wstępnie również dawki szczepionki.
- Badania kliniczne II fazy obejmują udział kilkuset ochotników i prowadzone są w celu potwierdzenia wyboru optymalnych dawek oraz określenia najczęstszych działań niepożądanych. Celem tych badań jest również wykazanie, czy szczepionka wywołuje optymalną odpowiedź immunologiczną.
- Badania kliniczne fazy III obejmują udział tysięcy ochotników. Celem tej fazy badań klinicznych jest wykazanie skuteczności szczepionki oraz zbadanie jej profilu bezpieczeństwa.
Restrykcyjne wymogi
Za dopuszczenie do obrotu szczepionek pandemicznych odpowiada Komisja Europejska. Najpierw KE musi uzyskać pozytywną rekomendację Komitetu ds. Produktów Leczniczych Stosowanych u Ludzi działającego w ramach Europejskiej Agencji Leków (European Medicines Agency – EMA).
Zanim szczepionka trafiła na rynek, przeprowadzono następujące procedury:
- przegląd etapowy – narzędzie regulacyjne wykorzystywane przez EMA do zintensyfikowania i przyspieszenia oceny danej szczepionki pandemicznej. W tej procedurze, przed rozpoczęciem właściwego postępowania rejestracyjnego, CHMP sukcesywnie dokonuje oceny dostępnych danych z trwających badań. Rolling review jest kontynuowane do czasu uzyskania wystarczających dowodów jakościowych, przedklinicznych i klinicznych na poparcie formalnego wniosku o wydanie pozwolenia na dopuszczenie do obrotu danej szczepionki;
- przyspieszona ocena – jest to skrócona procedura oceny merytorycznej dokumentacji rejestracyjnej produktów o dużym znaczeniu dla zdrowia publicznego z 210 do mniej niż 150 dni;
- warunkowe dopuszczenie do obrotu – jeżeli zgodnie z opinią CHMP m.in. stosunek korzyści do ryzyka jest pozytywny oraz korzyści dla zdrowia publicznego wynikające z natychmiastowej dostępności produktu leczniczego na rynku przeważają nad ryzykiem wynikającym z potrzeby uzyskania dalszych danych może zostać przyznane pozwolenie warunkowe.
W procedurze scentralizowanej wniosek o dopuszczenie do obrotu rozpatruje Komitet ds. Produktów Leczniczych Stosowanych u Ludzi. Członkowie Komitetu oraz eksperci ze wszystkich krajów członkowskich UE dokładnie analizują dokumentację produktu. Tę dokumentację przygotowują m.in. dwa niezależne zespoły ekspertów. Przed wydaniem pozwolenia na dopuszczenie do obrotu właściwe organy sprawdzają zgodność danych zawartych w przedstawionej dokumentacji. Firmy farmaceutyczne muszą zagwarantować, że badania kliniczne spełniają surowe wymagania Unii Europejskiej. Zaangażowanie zespołów ekspertów ze wszystkich krajów UE zapewnia najwyższy poziom ocen. Co ważne, te oceny są niezależne i bezstronne.
Prowadzona jest też intensywna współpraca z agencjami narodowymi. Opinie nt. szczepionki wydają m.in. eksperci Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych pracujący na rzecz komitetów naukowych oraz grup roboczych EMA. W posiedzeniach specjalnej grupy EMA dedykowanej COVID-19 biorą udział także specjaliści z Polski.
Źródła:
1. https://www.gov.pl/web/szczepimysie/materialy-informacyjne-dla-szpitali-i-pacjentow-dotyczace-szczepien-przeciw-covid-19
opublikowane na stronach www.gov.pl w dn. 25.12.2020 r.
2. https://www.gov.pl/web/szczepimysie/bezpieczenstwo
opublikowane na stronach www.gov.pl w dn. 28.12.2020 r.
Tagi: szczepienia przeciwko COVID-19